Een ionische stof ofwel zout is opgebouwd uit zowel positieve als negatieve ionen, zodat de totale lading gelijk is aan nul. Deze vormen meestal een regelmatig patroon (een ionrooster). Hierdoor hebben ionische stoffen een kristalstructuur.
Formule van een ionische stof:
- eerst het positieve ion, dan het negatieve ion; laat de ladingen weg
- schrijf de verhoudingsgetallen
- samengestelde ionen met een verhoudingsgetal groter dan één moeten tussen haakjes
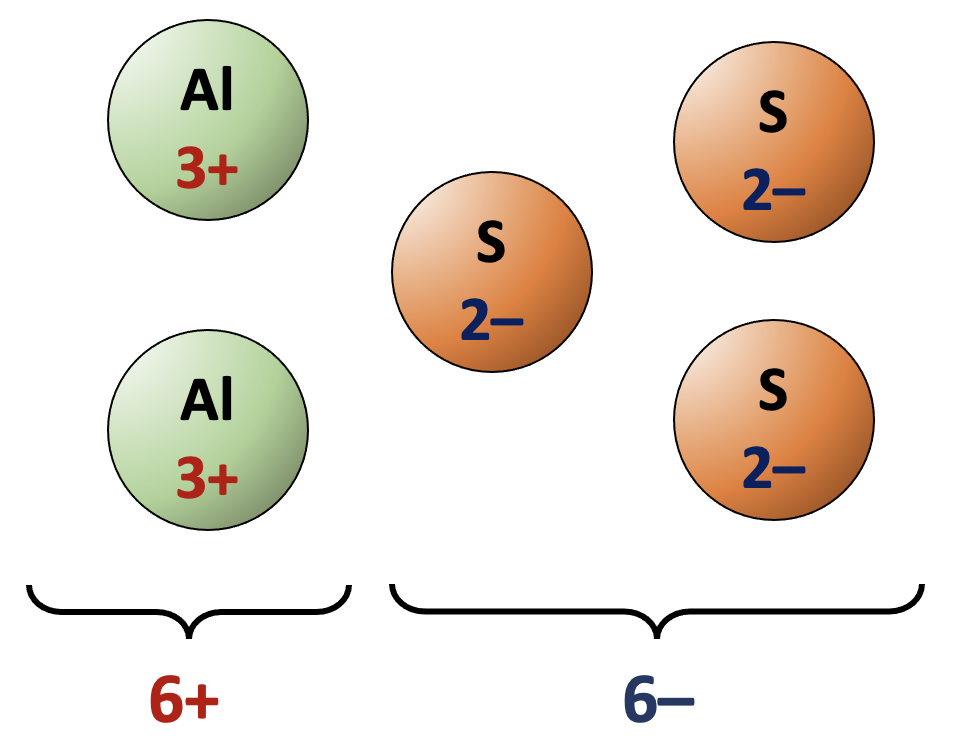
Chemische stoffen zijn elektrisch neutraal. De positieve en negatieve ladingen van ionen moeten elkaar dus opheffen. Dit bepaalt de verhoudingsgetallen.
- Als de positieve en negatieve ionen even grote ladingen hebben, is de verhouding 1:1. Voorbeelden: Na+ en Cl– vormen NaCl; Ca2+ en O2– vormen CaO.
- In andere gevallen “verwisselt” men de landingen kruiselings: Al3+ en S2– vormen Al2S3; met Mg2+ en F– krijgt men MgF2; met K+ en N3– wordt het K3N.
- In een paar gevallen moet men de verhouding delen door een gemeenschappelijk deler. De verbinding van Pb4+ en O2– wordt niet geschreven als Pb2O4 maar als PbO2.
Voorbeelden:
- CaCl2, calciumchloride (Ca2+ en Cl–)
- Fe2S3, ijzer(III)sulfide (Fe3+ en S2–)
- Al(NO3)3, aluminiumnitraat (Al3+ en NO3–)
- (NH4)2SO4, ammoniumsulfaat (NH4+ en SO42–)
