Beschouw de reactie tussen zoutzuur (HCl) en zink (Zn). De stoffenvergelijking is:
$$2 \; \text{HCl (aq)} + \text{Zn (s)} \rightarrow \text{ZnCl}_2 \; \text{(aq)} + \text{H}_2 \; \text{(g)}.$$
Maar in oplossing de HCl-moleculen geïoniseerd: H+ en Cl– zijn afzonderlijk aanwezig in de oplossing. Dat geldt ook voor de Zn2+ en Cl– na de reactie. Het is dus nauwkeuriger om te schrijven:
$$2\; \text{H}^+ \text{(aq)} + 2 \; \text{Cl}^- \; \text{(aq)} + \text{Zn (s)} \rightarrow \text{Zn}^{2+} \; \text{(aq)} + 2 \; \text{Cl}^- \; \text{(aq)} + \text{H}_2 \; \text{(g)}.$$
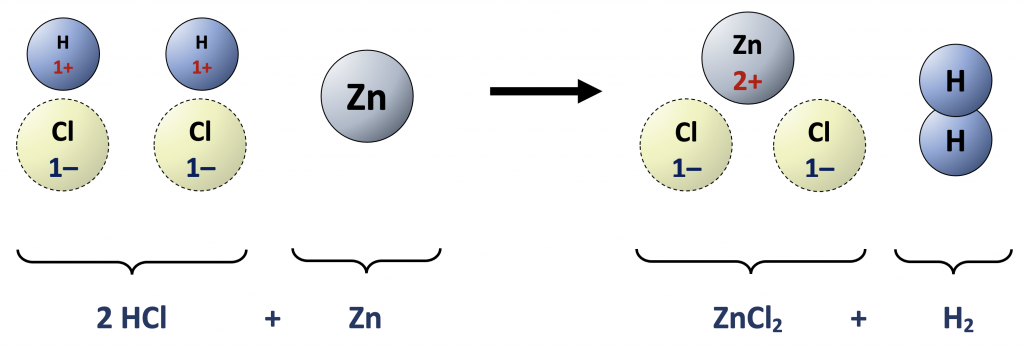
De Cl–-ionen blijven dus onveranderd in deze reactie; het zijn tribune–ionen. Laat deze weg om de essentiële ionenvergelijking te verkrijgen:
$$2 \; \text{H}^+ \; \text{(aq)} + \text{Zn (s)} \rightarrow \text{Zn}^{2+} \; \text{(aq)} + \text{H}_2 \; \text{(g)}.$$
In deze vorm is beter te zien wat er nu eigenlijk gebeurt: de positieve lading van de waterstofionen schuift naar de zinkionen.
