Wanneer een chemische reactie plaatsvindt, moeten er meestal eerst bindingen verbroken worden voor er nieuwe bindingen gevormd worden. Voor die eerste stap is energie nodig; bij de tweede stap komt energie vrij. Er is dus een “energiedrempel”: de botsende deeltjes moeten genoeg energie hebben om een reactie te laten beginnen. De hoogte van deze “energiedrempel” heet activeringsenergie.

Men moet de activeringsenergie niet verwarren met de reactie-energie. De reactie-energie is de netto hoeveelheid chemische energie die in een reactie vrijkomt of verbruikt wordt. Deze heeft geen direct verband met de activeringsenergie.
Bovenstaande grafieken laten ook het verschil zien tussen een endotherme en een exotherme reactie:
- In een endotherme reactie (links) is de chemische energie na de reactie hoger dan vóór de reactie. De extra energie wordt onttrokken aan de omgeving, waardoor de temperatuur afneemt. De reactie-energie (∆E, ∆H) is positief.
- In een exotherme reactie (rechts) is de chemische energie na de reactie lager dan vóór de reactie. De extra energie wordt vrijgegeven aan de omgeving, waardoor de temperatuur toeneemt. De reactie-energie (∆E, ∆H) is negatief.
Voorbeeld: Bij het verbranden van hout is de activeringsenergie vrij hoog: men moet een behoorlijke hoeveelheid energie aanleveren om de reactie te laten beginnen (bijv. door de vlam van een aansteker). Als de energie eenmaal verloopt, komt alle activeringsenergie vrij, plus een flinke hoeveelheid extra energie (de reactie-energie).
Men kan een reactie versnellen door een katalysator toe te voegen. Dit is een stof die in de reactie mee doet, maar er uiteindelijk onveranderd uitkomt. Het netto-effect van een katalysator is een verlaging van de activeringsenergie. De reactie kan hierdoor gemakkelijker (en dus sneller) verlopen.
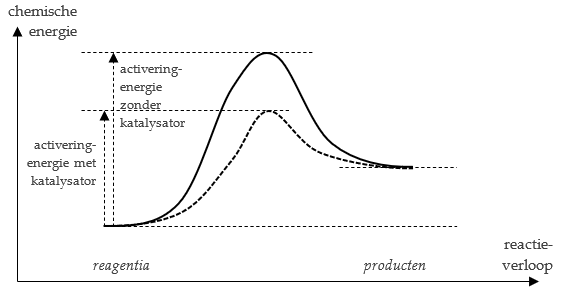
Voorbeeld: Waterstofperoxide ontbindt spontaan in water en zuurstofgas: $2 \; \text{H}_2\text{O}_2 \; \text{(aq)}\rightarrow 2 \; \text{H}_2\text{O (l)} + \text{O}_2 \;\text{(g)}.$ . Deze reactie verloopt over het algemeen langzaam. Door toevoeging van een kleine hoeveelheid kaliumjodide (KI) verloopt de reactie veel sneller. De KI wordt niet opgebruikt; het is een katalysator.
