Zoals hierboven beschreven geeft pH aan hoeveel H3O+-ionen aanwezig zijn. Hoe lager de pH, des te meer hydronium een oplossing bevat, en dus des te zuurder deze is. De pH wordt dan ook wel zuurgraad genoemd. Wij noemen een oplossing
- zuur als pH < 7
- neutraal als pH = 7
- basisch als pH > 7.
De zuurgraad van een oplossing hangt af van het soort zuur of base dat aanwezig is, maar ook van de hoeveelheid zuur. Gegeven de concentratie van een zuur [HZ]0 of base [B–]0 die wordt opgelost in water, hoe kan men nu de pH bepalen?
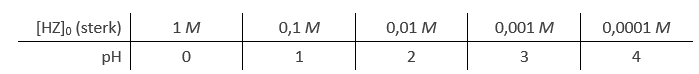
- Wanneer een sterk zuur HZ in water wordt opgelost, zal het geheel in H3O+ worden omgezet. Nadat de reactie is afgelopen geldt dus: [H3O+] = [HZ]0 en dus ook
$$\mathrm{pH = – log [HZ]_0.}$$
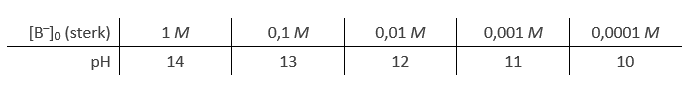
Wanneer een sterke base B– in water wordt opgelost, zal het geheel reageren en OH– vormen. Nadat de reactie is afgelopen geldt dus $\mathrm{[OH^-] = [B^-]_0}$ en dus ook $\mathrm{pOH = – \log [B^-]_0}$.Er volgt
$$\mathrm{pOH = -\log [B^-]_0, \;\;\; pH = 14 – pOH}.$$
Wordt een zwak zuur HZ in water wordt opgelost, dan zal slechts een deel in H3O+ worden omgezet. De oplossing is dus minder zuur dan men bij een sterk zuur zou verwachten; de pH-waarde ligt tussen -log[HZ]0 en 7.
Voor een precieze berekening gebruikt men de definitie van Ka. Wij doen twee redelijke aannames: (1) slechts een zeer klein deel van het zuur zal H+-ionen afstaan; (2) de hoeveelheid H3O+-ionen ten gevolge van water is te verwaarlozen. Laat [HZ]0 de hoeveelheid opgelost zuur zijn, en schrijf x voor de hoeveelheid (in mol/L) die H+-ionen afstaat aan water. Dan hebben wij
$$k_a = \mathrm{\frac{[Z^-][H_3O^+]}{[HZ]} = \frac{x \cdot x}{[HZ]_0}};$$
zodat
- $\mathrm{H_3O^+] = x = \sqrt{[HZ]_0 \cdot K_a}}$
- Neem de negatieve logaritme en men verkrijgt
- $\mathrm{pH = \frac{1}{2}(p}K_a – \log [\mathrm{HZ}]_0)$
Wanneer een zwakke base B– in water wordt opgelost, zal slechts een deel reageren en OH– vormen. De oplossing is dus minder basisch dan men bij een sterke base zou verwachten; de pH-waarde ligt tussen 7 en 14 – (- log [HZ]0. Gebruikmakend van bovenstaande techniek vindt men voor een zwakke base
- $pOH = \frac{1}{2}(\mathrm{p}K_b – \log [\text{B}^-]_))$.
Wat is de pH van een 0,01 M NaOH oplossing?
- Hier heeft men te maken met een sterke base. De oplossing zal dus 0,01 M OH–-ionen bevatten:
pOH = –log 0,01 = 2 pH = 14 – 2 = 12.
Wat is de pH van een 0,05 M CH3COOH oplossing? Gegeven: pKa = 4,76.
- Hier gaat het om een zwak zuur. Slechts een deel van het azijnzuur zal een proton afstaan aan water en H3O+ Dus is [H3O+] < 0,05 mol/L, en pH > – log 0,05 ≈ 1,3. De pH-waarde zal derhalve tussen 1,3 en 7 liggen.
- De precieze berekening verloopt als volgt, met x = [H3O+] = [CH3COO–]:
$$K_a = 10^{-4,76} = \frac{x \cdot x}{0,05}$$ $$\mathrm{[H_3O^+] = x = \sqrt{10^{-4,76} \cdot 0,05} = 0,00094 \frac{mol}{L}}$$ $$\mathrm{pH = – \log 0,00093 = 3,03}$$
Wat is de pH van een 0,1 M H2SO4 oplossing?
- Zwavelzuur is een sterk zuur. Er zal dus 0,1 M H3O+-ionen ontstaan en pH = –log 0,1 = 1.
- (Dit antwoord is niet geheel correct. De geconjungeerde base, HSO4–, is zelf een zwak zuur. Het zal daarom een kleine extra bijdrage leveren aan H3O+; de zuurgraad is iets kleiner dan 1. Zou alle HSO4– ionizeren (als een sterk zuur), dan heeft men uiteindelijk 0,2 M H3O+-ionen en pH = 0,7. Dus weten wij zeker dat 0,7 < pH < 1,0.)
