Een galvanische cel gebruik een redoxreactie voor het opwekken van elektrische stroom. Het bestaat uit
- twee halfcellen, waarin de halfreacties (oxidatie, reductie) plaatsvinden;
- elektroden, één in elke halfcel:
- de anode (–) in de oxidatie-halfcel, om elektronen af te voeren
- de kathode (+) in de reductie-halfcel, om elektronen aan te voeren
- een zoutbrug, waar ionen doorheen bewegen om de ladingen in de halfcellen neutraal te houden
- een elektrische schakeling die de anode met de kathode verbindt
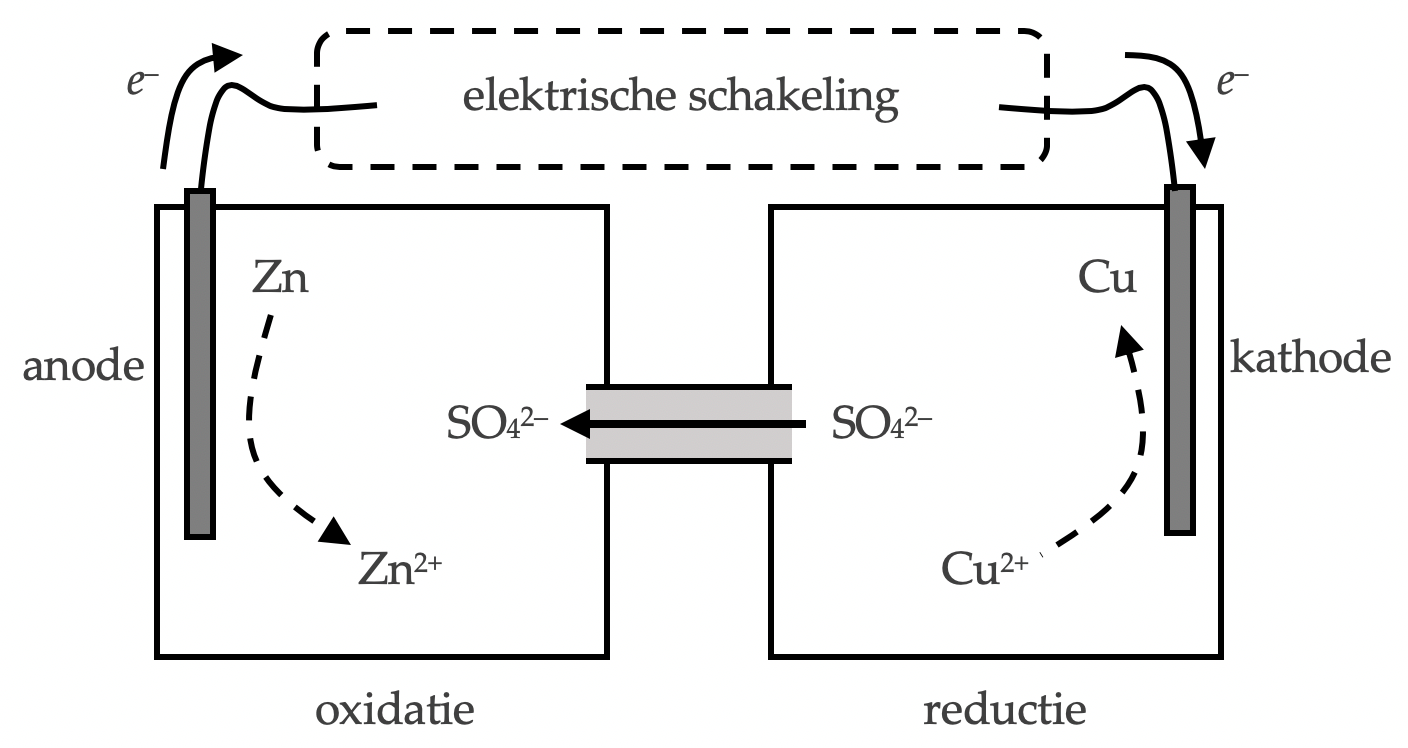
Halfcel 1 bevat een zink-anode in een oplossing van zinksulfaat; halfcel 2 bevat een zink-kathode in een oplossing van kopersulfaat.
In halfcel 1 vindt oxidatie plaats: $\mathrm{Zn \rightarrow Zn^{2+} + 2 e^-}$.
De zinkelektrode lost dus op, en de losgemaakte elektronen worden bij de anode de elektrische schakeling “ingeduwd”.
In halfcel 2 vindt reductie plaats: $\mathrm{Cu^{2+} + 2 e^- \rightarrow Cu}$.
De koperelektrode groeit, en de benodigde elektronen worden bij de kathode uit de elektrische schakeling “getrokken”.
SO42–-ionen bewegen zich door de zoutbrug van halfcel 2 naar halfcel 1, zodat elke halfcel elektrisch neutraal blijft.
Als er een gesloten stroomkring is, gaat er elektrische stroom lopen door de schakeling van anode naar kathode.
De elektrische spanning van een galvanische cel is het verschil tussen de reductiepotentialen.
Als de halfcellen in bovenstaande situatie een concentratie hebben van 1 mol/L, dan is de elektrische spanning
$$\mathrm{E_{cel} = E_{red} – E_{ox} = (+0,34 \; V) – (-0,76\;V) = 1,10 \;V}$$
Halfcellen worden vooral toegepast in batterijen. Bij een herlaadbare batterij (accu) kan men de elektronen in de omgekeerde richting dwingen, zodat de omgekeerde reacties plaatsvinden.
Bij de accu van een auto zijn de halfcellen samengevoegd in een enkel vat dat zwavelzuur bevat (H+ en HSO4–). De anode bestaat uit lood, de kathode uit lood(IV)oxide. De volgende reacties vinden plaats:
anode: $\mathrm{Pb \; (s) + HSO_4^- \; (aq) \rightarrow PbSO_4 \; (s) + H^+ \; (aq) = 2\; e^-}$
kathode: $\mathrm{PbO_2 \; (s) + HSO_4^- \; (aq) + 3H^+ \; (aq) + 2e^- \rightarrow PbSO_4 \; (s) + 2 H_2O\; (l)}$.
Bij de anode wordt lood geoxideerd van Pb naar Pb2+, en bij de kathode reduceerd van Pb4+ naar Pb2+. Er is geen zoutbrug nodig: het ladingsevenwicht wordt in stand gehouden door H+-ionen die zich vrij kunnen bewegen in het reactievat.
