Elektronen hebben de neiging in een zo laag mogelijke energie te gaan zitten (de grondtoestand van het atoom). Men zou dus verwachten dat lagere niveaus geheel gevuld raken. Dit is in principe waar, maar door de aanwezigheid van andere elektronen wordt alles net wat ingewikkelder.
Volgens het opbouwprincipe kan men de elektronenconfiguratie van een atoom bepalen door de elektronen als volgt in hun niveaus en subniveaus te plaatsen:
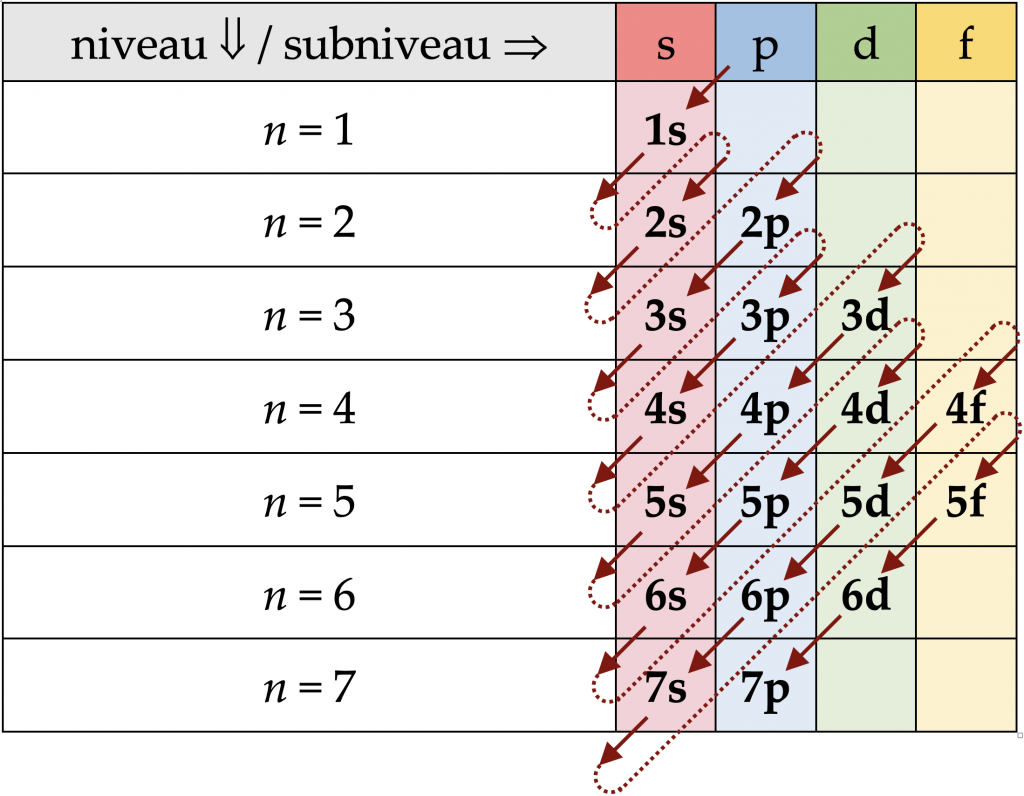
- de eerste twee elektronen in 1s ;
- dan twee elektronen in 2s
- en zes in 2p ;
- dan twee elektronen in 3s
- en zes in 3p ;
- dan twee elektronen in 4s
- en tien in 3d (!)
- en zes in 4p ;
- dan twee elektronen in 5s
- en tien in 4d
- en zes in 5p ;
- dan twee elektronen in 6s
- en veertien in 4f (!)
- en tien in 5d
- en zes in 6p ;
- dan twee elektronen in 7s
- en veertien in 5f , (!)
De grafiek rechts geeft een goede “diagonaalmethode” om deze volgorde te onthouden.
Voorbeeld: Bepaal de elektronenconfiguratie van een neutraal zwavelatoom.
Het atoomgetal van zwavel (S) is 16; omdat het neutraal is zal het dus 16 elektronen hebben.
Wij plaatsen deze volgens het opbouwprincipe: 1s2 2s2 2p6 3s2 3p4.
Subniveau 3p is dus niet geheel gevuld. Ga na dat het totaal aantal elektronen nu 16 is.
Voorbeeld: Elektronenconfiguratie van een neutraal zilveratoom:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9.
Opmerkingen:
- Men verkort elektronenconfiguraties vaak door uit te gaan van een edelgas (He, Ne, Ar, Kr, Xe, Rn). Deze hebben gemeen dat zij een p-subniveau net geheel gevuld hebben. Dus schrijft men voor zwavel: [Ne] 3s2 3p4; en voor zilver: [Kr] 5s2 4d9.
- Het hier beschreven opbouwprincipe is goed, maar niet volmaakt. Vooral bij het vullen van de d- en f-niveaus zijn er kleine afwijkingen. De juiste configuratie voor zilver is bijv. [Kr] 5s1 4d10.
