De valentie-elektronen zijn de elektronen in het hoogste niveau. In chemische reacties zijn vooral de valentie-elektronen van een atoom betrokken.
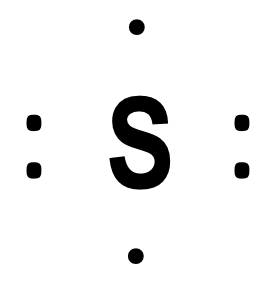
Voorbeeld: zwavel, met elektronenconfiguratie 1s2 2s2 2p6 3s2 3p4, heeft zes valentie-elektronen (2 + 4).
Uit het opbouwprincipe volgt dat alleen elektronen in s- en p-niveaus valentie-elektronen kunnen zijn. Er zijn dus maximaal acht valentie-elektronen. De atoomsoorten met een maximaal aantal valentie-elektronen zijn precies de edelgassen.
In een Lewisformule geeft men de valentie-elektronen in een atoom weer als stippen. Het (neutrale) zwavelatoom wordt bijvoorbeeld zo geschreven: