Een molecuul is polair (een dipool) als
- het één of meer polaire covalente bindingen bevat (paragraaf 27.1); en
- de richting van deze polaire covalente bindingen elkaar niet opheffen.
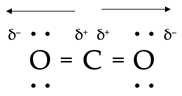
Voorbeelden:
- Koolstofdioxide, CO2.
- De O-atomen zijn sterk elektronegatief vergeleken met het C-atoom, en trekken dus elektronen naar zich toe. Het sterisch getal van het C-atoom is 2; dus is het molecuul lineair. Omdat de elektronen precies in omgekeerde richting worden getrokken, heffen
 deze effecten elkaar op; het molecuul is niet polair.
deze effecten elkaar op; het molecuul is niet polair. -
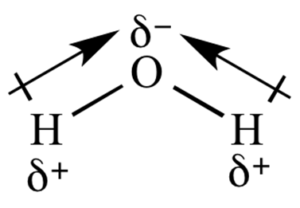
- Water, H2
- Het O-atoom is sterk elektronegatief vergeleken met de H-atomen, en trekt dus elektronen naar zich toe. Het sterisch getal van het O-atoom is 4 (twee bindingen en twee vrije elektronenparen); dus is het molecuul tetraëdrisch, met hoeken van ongeveer 109,5˚. De richtingen heffen elkaar nu niet precies op, en het molecuul is wel polair.
- Vergelijk BF3 (sterisch getal 3) en NF3 (sterisch getal 4, want vrij elektronpaar).
BF3 is vlak en geen dipool; NF3 is ruimtelijk en een dipool (δ– aan de kant van de fluoratomen).
