In het vorige hoofdstuk werden de vormen van elektronenorbitalen besproken: een s-orbitaal is bolvormig, en de p-orbitalen zijn haltervormig en staan loodrecht op elkaar (px, py, pz). Hoe kan het dan dat in een molecuul de elektronen bindingen vormen in specifieke richtingen?
Onder invloed van genabuurde atomen vormen de s– en p-orbitalen hybride orbitalen, mengsels van de orbitalen in het alleenstaande atoom. De details van dit proces worden in de kwantummechanica precies uitgewerkt. Het is meestal voldoende om drie gevallen te onderscheiden aan de hand van het sterisch getal.
Een covalente binding wordt gevormd als twee van deze hybride orbitalen, één uit elk atoom, elkaar overlappen. (Technisch gezien levert weer twee orbitalen, een bindingsorbitaal en een antiindingsorbitaal. De bindingsorbitaal heeft een veel kleinere energie; daar komen de bindingselektronen terecht.)
- Een σ-binding wordt gevormd door de directe overlap van sp?-orbitalen die in elkaars verlengde liggen (of, in het geval van waterstof, overlap van een sp?-orbitaal met de 1s-orbitaal.)
- Een π-binding wordt gevormd door de zijdelingse overlap van evenwijdige p-orbitalen.
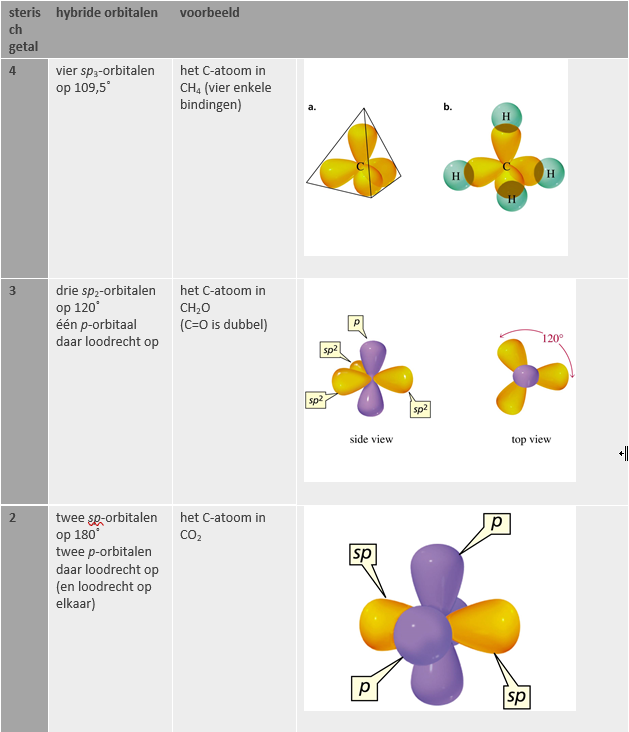
ethaan (C2H6)
enkele binding C–C
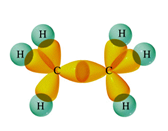
etheen (C2H4)
dubbele binding C=C
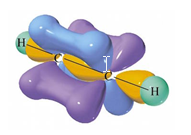
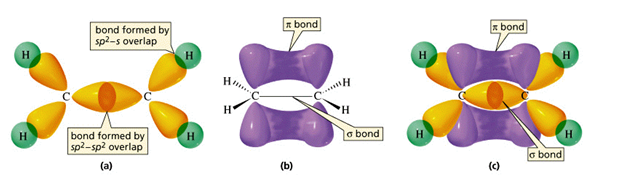
ethyn (C2H2)
drievoudige binding C$\equiv$C
Nu geven wij deze theorie van molecuulorbitalen een plaats binnen het voorgaande model.
- Een enkele binding bestaat uit een σ-binding.
- Een dubbele binding bestaat uit een σ-binding en een π-binding.
- Een drievoudige binding bestaat uit een σ-binding en twee π-bindingen.
