Een formule zoals $v = k [\text{H}_2][\text{NO}]^2$ beschrijft hoe de reactiesnelheid afhangt van de concentraties. De reactiesnelheidsconstante k is daarbij niet echt een constante, maar afhankelijk van de temperatuur en de activeringsenergie. De formule van Arrhenius geeft hiervan een meer gedetailleerde beschrijving.
$$k = k_0 e ^{- \frac{E_a}{RT}}$$
Hierbij is k0 een constante, Ea de activeringsenergie, R de gasconstante en T de 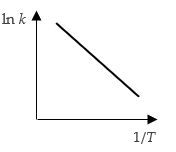 temperatuur in kelvin. Belangrijke aspecten aan dit model:
temperatuur in kelvin. Belangrijke aspecten aan dit model:
- Als de temperatuur toeneemt, neemt de reactiesnelheid ook toe.
- Hoe lager de activeringsenergie, des te sneller de reactie verloopt. Dit beschrijft het effect van een katalysator.
- Er bestaat een (negatief) lineair verband tussen log k en 1/T.
