Als men tijdens het titreren een pH-meter in het mengsel hangt, kan men (handmatig of met de computer) een titratiekromme maken. Hierbij wordt de pH uitgezet tegen de hoeveelheid toegevoegd titreermiddel.
De titratiekromme van de titratie van een zwak zuur met een sterke base:
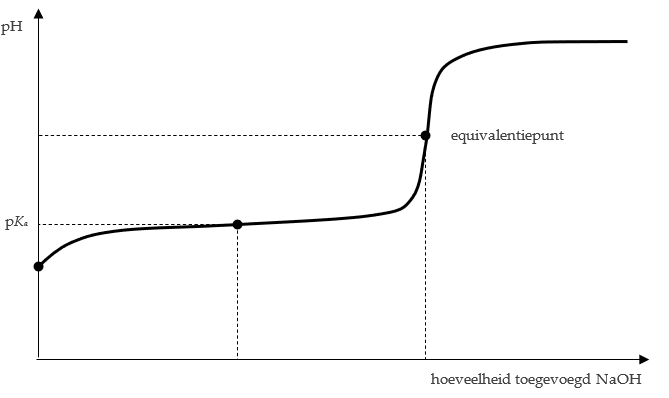
Eigenschappen van een titratiekromme:
- Bij het titreren van een zuur met een base loopt de grafiek omhoog; bij het titreren van een base met een zuur loopt de grafiek omlaag.
- Bij het equivalentiepunt loopt de grafiek zeer steil.
- Wanneer men een sterk zuur of een sterke base titreert, zal bij het equivalentiepunt de pH gelijk zijn aan 7. Bij een zwak zuur of zwakke base is dit niet het geval.
- Wanneer men een zwak zuur of een zwakker base titreert, bevat de grafiek een vrijwel horizontaal deel. Het mengsel is dan een buffer. Dit gebeurt precies halverwege tussen het begin van de titratie en het equivalentiepunt. Er geldt dan bovendien dat pH = pKa. (Bij een sterk zuur of een sterke base is er geen horizontaal gedeelte.)
- Bij een meervoudig zuur of base (diprotisch, triprotisch) zal men twee of drie equivalentiepunten vinden op gelijke afstand.
