De neiging van een stof om elektronen op te nemen (gereduceerd te worden) wordt uitgedrukt door de reductiepotentiaal. Deze wordt gemeten in volt (V), de SI-eenheid voor elektrische spanning.
De reductiepotentiaal van een stof in een oplossing hangt af van zijn concentratie. Voor het gemak gaan wij uit van een “standaardoplossing”, met een concentratie van 1 M bij gewone temperatuur en druk. Men spreekt dan van de standaardreductiepotentiaal, Eo.
Standaardreductiepotentialen staan getabelleerd in chemische naslagwerken en hoef je niet uit het hoofd te leren. Een aantal voorbeelden:
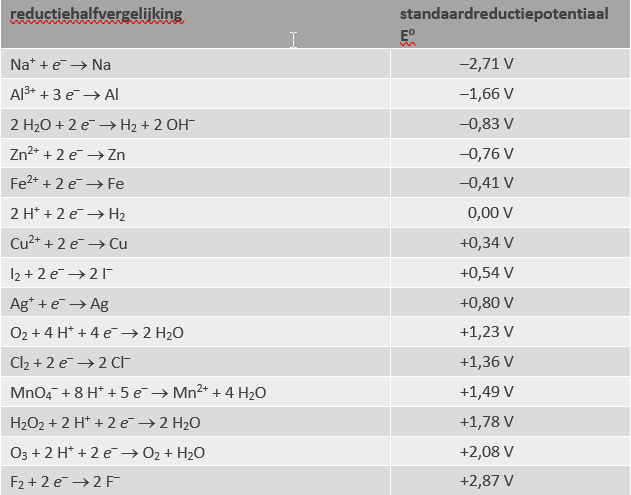
- Bovenaan / lage Eo:
- stoffen die niet graag elektronen opnemen
- de reactie (reductie) zal niet of nauwelijks verlopen
- de omgekeerde reactie (oxidatie) juist wel
- de producten (Na, Zn, enz.) zijn goede reductoren
- Bovenaan / lage Eo:
- stoffen die graag elektronen opnemen
- de reactie (reductie) zal gemakkelijk verlopen
- de omgekeerde reactie (oxidatie) juist niet
- de reagentia (F2, O3, enz.) zijn goede oxidatoren
Aan de hand van standaardreductiepotentialen kan men voorspellen of een redoxreactie zal verlopen.
- Stel de halfvergelijkingen op.
- Bepaal de (standaard)reductiepotentiaal voor de reductiehalfvergelijking (Ered) en voor de omgekeerde oxidatiehalfvergelijking (Eox).
- Als Ered > Eox, zal de reactie spontaan verlopen.
Zal koper (Cu) met jood (I2) reageren?
De relevante halfvergelijkingen zijn
$\mathrm{I_2 + 2 e^- \rightarrow 2I^-}$ (reductie) en $\mathrm{CU \rightarrow Cu^{2+} + 2 e^-}$ (oxidatie)
De bijbehorende reductiepotentialen zijn Ered = +0,54 V en Eox = +0,34 V.
Omdat Ered > Eox, zal de reactie spontaan verlopen.
De volledige vergelijking is: $\mathrm{I_2 + Cu \rightarrow 2 I^- + Cu^{2+}}$
Kan men waterstofgas vormen door zuur over zilver te gieten? De relevante halfvergelijkingen zijn
$\mathrm{2H^+ + 2 e^- \rightarrow H_2}$ (reductie) $\mathrm{Ag \rightarrow Ag^+ + e^-}$ (oxidatie)
De bijbehorende reductiepotentialen zijn Ered = 0,00 V en Eox = +0,80 V.
Omdat Ered < Eox, zal de reactie niet verlopen.(De omgekeerde reactie zal wél verlopen.)
