In een neerslagreactie verlaten opgeloste ionen de oplossing en vormen zij een vaste stof. Dit is het omgekeerde van oplossing: $$\text{Ca}^{2+} \; \text{(aq)} + \text{CO}_{3}^{2-} \; \text{(aq)} \rightarrow \text{CaCO}_3 \; \text{(s)}.$$
Een dergelijk proces is te verwachten wanneer een oplossing ionsoorten bevat die samen een slecht-oplosbare combinatie vormen. Een belangrijke toepassing hiervan is het mengen van twee zoutoplossingen. Vaak zal hierbij een nieuw zout gevormd worden dat neerslaat. Om deze reactie te bepalen, doet men het volgende:
- Bepaal welke positieve en negatieve ionen in de oorspronkelijke oplossingen aanwezig zijn.
- Ga na welke twee nieuwe combinaties deze zouden kunnen vormen.
- Als een van deze combinaties slecht oplosbaar is, zal die combinatie neerslaan als vaste stof.
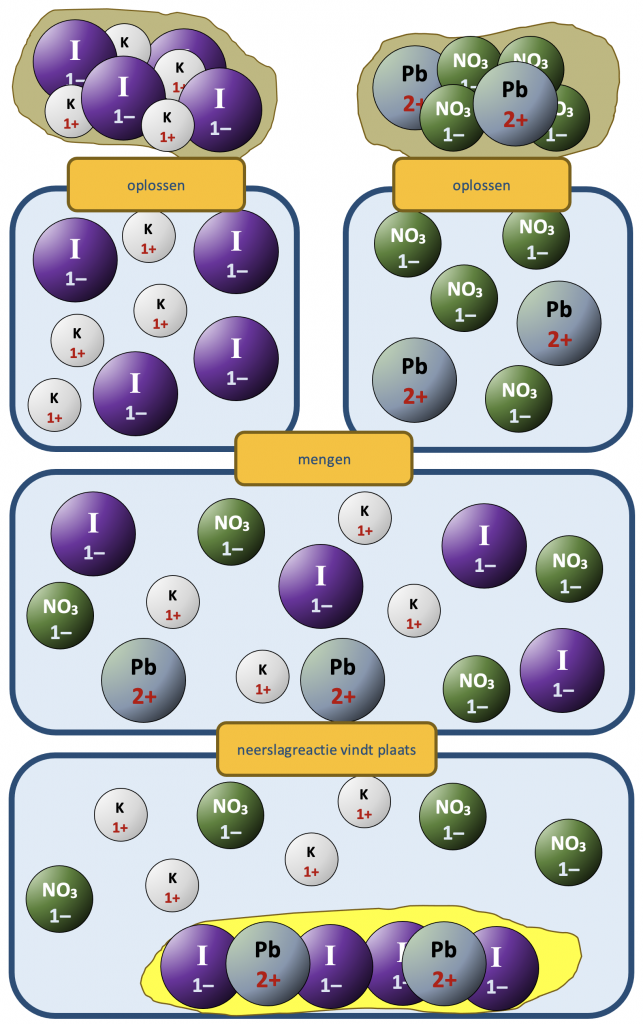
Als een oplossing van kaliumjodide wordt gemengd met een oplossing van lood(II)nitraat, Pb(NO3)2, slaat een felgeel zout neer. Schrijf de reactievergelijking.
- De oorspronkelijke stoffen zijn KI (met K+-ionen en I–-ionen) en Pb(NO3)2 (met Pb2+-ionen en NO3–-ionen).
- Nieuwe combinaties van positieve en negatieve ionen zijn
$$\text{K}^+ \text{en NO}_{3}^{-}; \;\;\; \text{Pb}^{2+} \; \text{en I}^-.$$
- De eerste combinatie goed oplosbaar is (alle nitraten zijn goed oplosbaar); de tweede combinatie is slecht oplosbaar. Daarom zullen lood en jodide samen neerslaan. Het zout dat gevormd wordt, lood(II)jodide, heeft formule PbI2.
- De essentiële ionenvergelijking voor dit proces is eenvoudigweg
$$\mathrm{Pb^{2+}\ (aq) + 2\ I^-\ (aq) \to PbI_2\ (s)}.$$ - De stoffenvergelijking heeft de volledige formules voor de oorspronkelijke opgeloste stoffen, inclusief de tribune-ionen K+ en NO3–. Het kost wat werk om deze vergelijking in evenwicht te brengen:
$$\mathrm{2\ KI\ (aq) + Pb(NO_3)_2\ (aq) \to PbI_2\ (s) + 2\ KNO_3\ (aq)}.$$
Een en ander is hier uitgewerkt in een deeltjesdiagram.