In een chemische reactie verdwijnen stoffen (reagentia, ev. reagens) en worden nieuwe stoffen gemaakt (producten). Echter, de atomen veranderen hierbij niet.
Een reactievergelijking geeft de formules van de reagentia en producten:
$$ \text{reagens}_1 + \text{reagens}_2 + \text{…} \rightarrow \text{product}_1 + \text{product}_2 + \text{…}.$$
De vergelijkingen vertelt dus welke stoffen met elkaar reageren. Meestal voegt men ook informatie toe over de verhouding waarin zij reageren. Bijvoorbeeld:
$$\text{N}_2 + 3 \; \text{H}_2 \rightarrow 2 \; \text{NH}_3.$$
In woorden: elk molecuul stikstof (N2) reageert met drie moleculen waterstof (H2) en vormt twee moleculen ammonia (NH3). De getallen 3 en 2 heten coëfficiënten; als de coëfficiënt van een stof gelijk is aan 1, wordt deze weggelaten.
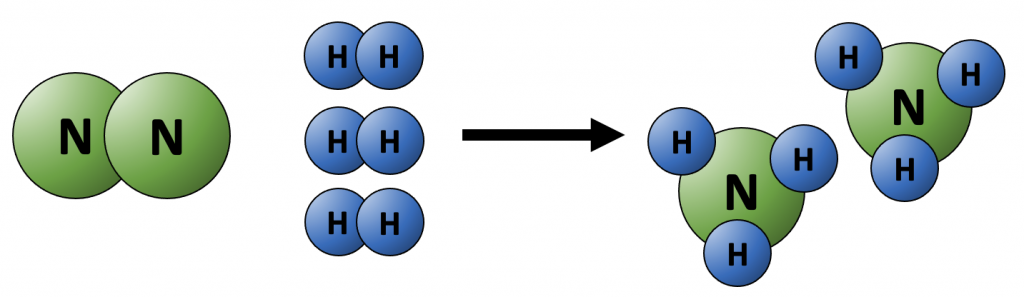
Bovenstaande reactievergelijking is in evenwicht, omdat het aantal atomen van elk soort gelijk is aan beide zijden van de vergelijking: 2 N-atomen en 6 H-atomen.
