Soms is het lastiger om de Lewisformule van een molecuul te bepalen, of zijn er meerdere mogelijkheden. Ga bij het beoordelen van een Lewisformule na:
- Het totaal aantal elektronenparen (bindingsparen en vrije elektronenparen) moet kloppen:
- Het aantal elektronen moet gelijk zijn aan het aantal valentie-elektronen dat elk atoom bijdraagt, plus of min extra elektronen als het molecuul elektrisch geladen is.
- Dat alle atomen minstens door een enkelvoudige binding aan de rest van het molecuul vastzitten. Een binding is op z’n hoogst drievoudig.
- Dat elk atoom aan de octetregel voldoet.
- Waterstof heeft altijd een enkelvoudige binding en geen vrije elektronenparen.
- Andere atomen hebben bij voorkeur vier elektronenparen om zich heen.
- Bij atoomsoorten in rij 3 en hoger (Si, P, S, Cl, Br, etc.) mag een atoom hypervalent zijn en dus meer dan vier elektronenparen om zich heen hebben.
- Dat atomen een “redelijke” formele lading
$$\text{formele lading} = \text{normaal aantal valentie-elektronen} – \text{bindingsparen} = 2 \cdot \text{#vrije elektronenparen}$$
- “Redelijk” betekent dat de formele lading zo dicht mogelijk bij nul zit.
Voorbeeld: Bepaal de Lewisformule voor het fosfaation, PO43-. 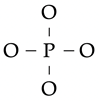
- Een eerste begin staat rechts getekend.
- Het P-atoom draagt 5 valentie-elektronen bij; elk O-atoom 2 valentie-elektronen. Het molecuul heeft –3 lading, dus een overschot van drie elektronen.
- In totaal zijn er dus 5 + 4×6 + 3 = 32 elektronen beschikbaar, ofwel 16 elektronenparen.
- Voeg aan elk zuurstofatoom drie vrije elektronenparen toe. Nu voldoet elk
 atoom aan de octetregel, en zijn er inderdaad 16 elektronenparen gebruikt (4 binding, 12 vrij).
atoom aan de octetregel, en zijn er inderdaad 16 elektronenparen gebruikt (4 binding, 12 vrij). - Bereken formele ladingen.
- P-atoom: 5 – (4 + 2×0) = +1.
- elk O-atoom: 6 – (1 + 2×3) = –1.
- De formele ladingen zijn dus vrij klein. Het totaal is (+1) + 4x(–1) = –3, wat inderdaad de totale lading van het fosfaation is.
- Deze Lewisstrucuur is niet slecht, maar kan verbeterd worden door een
 dubbele binding te gebruiken. Het P-atoom voldoet nu niet meer aan de octetregel, maar het mag hypervalent zijn. De formele ladingen zijn nu:
dubbele binding te gebruiken. Het P-atoom voldoet nu niet meer aan de octetregel, maar het mag hypervalent zijn. De formele ladingen zijn nu:
- P-atoom: 5 – (5 + 2×0) = 0.
- dubbelgebonden O-atoom: 6 – (2 + 2×2) = 0.
- overige O-atomen: 6 – (1 + 2×3) = –1.
- Deze formele ladingen liggen dichter bij nul en zijn dus beter. In werkelijkheid zal de structuur van PO43– een mengsel (ofwel resonantie) zijn van bovenstaande structuren.
