Er zijn theoretische modellen voor de chemische kinetiek, die de reactiesnelheid beschrijven als een functie van de concentraties van de reagentia. Deze hebben de volgende vorm:
$$v = k \cdot [\text{A}^a \cdot [\text{B}]^b …$$Hier zijn A, B, … de reagentia. De orde van de reactie ten opzichte van een reagens is gelijk aan de bijbehorende exponent. De grootheid k is de reactiesnelheidsconstante.
Voorbeeld: De reactie $2 \; \text{H}_2 \; \text{(g)} + 2 \; \text{NO (g)} \rightarrow \text{N}_2 \; \text{(g)}+ 2 \; \text{H}_\text{O} \; \text{(g)}$ wordt onderzocht. Het blijkt dat de reactie van orde 1 is t.o.v. H2 en van orde 2 t.o.v. NO. Dus kan men schrijven
$$v = k[\text{H}_2][\text{NO}]^2.$$Hieruit volgt bijvoorbeeld dat bij verdubbeling van de concentratie [NO] de reactie viermaal zo snel zal verlopen: de factor 2 wordt immers gekwadrateerd.
Soms wordt men gevraagd om de formule voor de reactiesnelheid te bepalen aan de hand van meetwaarden. Men kan dit doen door vermenigvuldigingsfactoren van de concentraties te vergelijken met vermenigvuldigingsfactoren van de reactiesnelheden.
Voorbeeld: Beschouw de reactie van waterstofgas en stikstofmonoxide bij hoge temperatuur (700˚C):
$$2 \; \text{H}_2 \; \text{(g)} + 2 \; \text{NO (g)} \rightarrow 2 \; \text{H}_2\text{O (g)} + \text{N}_2\; \text{(g)}.$$Door experimenteren vindt men de volgende reactiesnelheden:
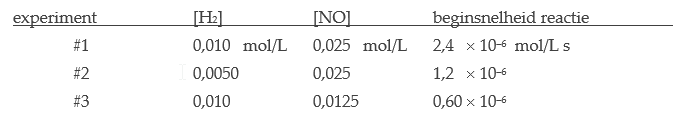
Schrijf een vergelijking voor de reactiesnelheid. Wat is de orde van deze reactie t.o.v. de reagentia?
- Van #1 naar #2 wordt de concentratie [H2] door twee gedeeld. De reactiesnelheid wordt eveneens door twee gedeeld. De reactiesnelheid is dus evenredig aan [H2]; d.w.z. de orde t.o.v. H2 is 1.
- Van #1 naar #3 wordt de concentratie [NO] door twee gedeeld. De reactiesnelheid wordt nu echter door vier gedeeld. De reactiesnelheid is dus evenredig aan het kwadraat van [NO]; de orde t.o.v. NO is 2.
- De reactiesnelheid voldoet dus aan de vergelijking
- Door een willekeurige regel uit de tabel in te vullen vindt men verder dat k = 0,384.
