Men verkrijgt een eenvoudige redoxreactie door een metaal met zuur te behandelen. Het metaal “lost op” en er komt waterstofgas vrij:
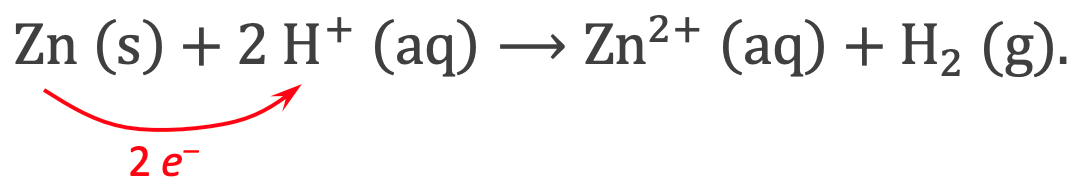
Tijdens deze reactie geeft het zinkatoom twee elektronen aan de H+-ionen.
- Een stof die elektronen verliest, ondergaat oxidatie. (Hierboven werd Zn geoxideerd
- Een stof die elektronen opneemt, ondergaat reductie. en H+)
Men gebruikt ook wel de volgende terminologie. (Helaas!) Let goed op om verwarring te voorkomen.
- Een oxidator is een stof die een andere stof oxidatie doet ondergaan.
- Een reductor is een stof die een andere stof reductie doet ondergaan.
De reductor zelf wordt dus geoxideerd, en de oxidator wordt gereduceerd!
