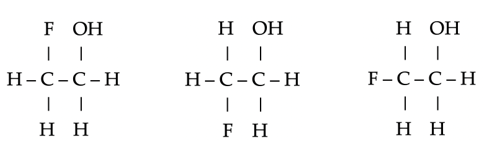Isomeren zijn stoffen die dezelfde molecuulformule hebben (zelfde aantallen van elk atoomsoort), maar een verschillende structuur. Het chemisch gedrag van isomeren kan heel verschillend zijn.
Bij structuurisomerie zijn atomen op verschillende manier aan elkaar verbonden.
- Ketenisomeren: Koolstofketens kunnen op verschillende manieren gebouwd zijn, bijv. met en zonder vertakkingen, of vertakkingen op verschillende plaatsen.
De vier structuurisomeren van C5H12. De H-atomen zijn niet getekend.
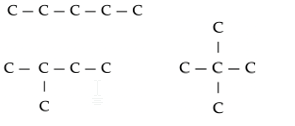
- Plaatsisomeren: Dezelfde functionele groep kan aan verschillende koolstofatomen gebonden zijn, of dubbele bindingen kunnen zich op verschillende plaatsen bevinden.
Drie plaatsisomeren voor de dubbele binding in C5H10.
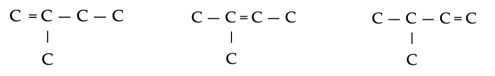
Plaatsisomeren van difluoroethaan, C2H4F2.
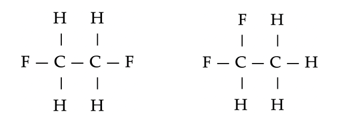
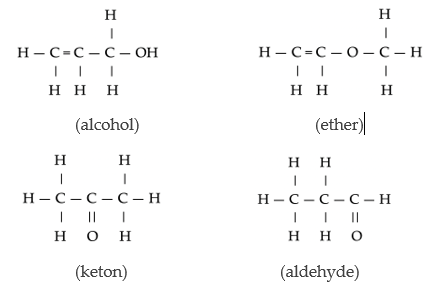
- Functie-isomeren: Er zijn verschillende functionele groepen.
Isomeren van C3H6O met verschillende functionele groepen.
Bij meetkundige isometrie speelt de precieze ruimtelijke structuur een rol.
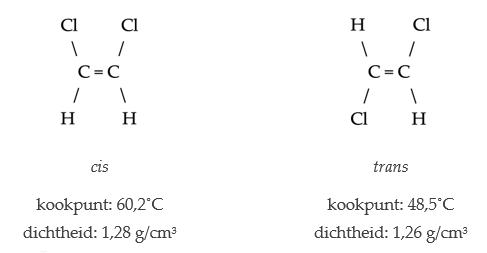
- Cis–transisomeren treden op als twee groepen zich hetzij aan dezelfde zijde (cis-) hetzij aan tegengestelde zijden (trans–) van een meervoudige binding of ring kan bevinden. (Bij enkele bindingen speelt dit geen rol, omdat in dat geval beide zijden vrij ten opzichte van elkaar kunnen draaien.)
Isomeren van 1,2-dichloroethaan. Door de rigide dubbele binding zijn deze stoffen wezenlijk verschillend.
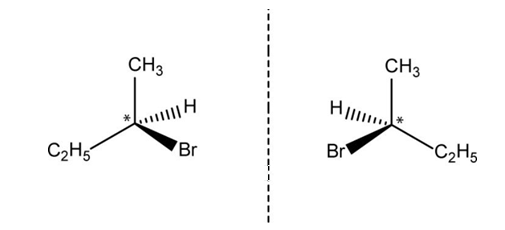
- Optische isomeren zijn spiegelbeelden van elkaar, net als een linkerschoen en een rechterschoen. Optische isomeren hebben in principe hetzelfde gedrag, maar in de natuur komen eiwitten voor die op dit punt kieskeurig zijn. Optische isomeren roteren de polarisatierichting van licht in tegengestelde richting, en kunnen dus door een experiment met gepolariseerd richt worden onderscheiden. Optische isomerie komt voor als het atoom een chiraal centrum heeft, meestal een C-atoom waaraan zich vier verschillende groepen bevinden.
2-broombutaan heeft optische isomeren.
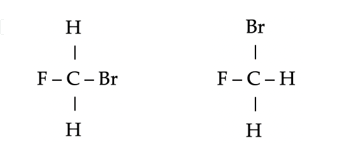
Opmerking: Houd goed in de gaten dat, hoewel structuurformules op papier plat zijn, de moleculen zelf ruimtelijk zijn. Dit betekent bijvoorbeeld dat de volgende paren moleculen identiek zijn.
Ook kunnen enkele bindingen in principe vrij draaien. De volgende drie structuurformules beschrijven daarom precies hetzelfde molecuul; er is hier geen sprake van cis-transisomerie of optische isomerie.