In bovenstaande voorbeelden speelden ionen een rol, en was er duidelijk sprake van ladingoverdracht via elektronen. Er zijn echter ook redoxreacties waar dit minder duidelijk is. Bijvoorbeeld, de verbranding van waterstof $$\mathrm{2 H_2 + O_2 \rightarrow 2 H_2O}$$
is óók een redoxreactie. We doen namelijk net of in H2O het waterstofatoom een “lading” +1 heeft, en het zuurstofatoom een “lading” –2. Dit is het idee van oxidatiegetallen.
- Een atoom ondergaat oxidatie als het oxidatiegetal toeneemt.
- Een atoom ondergaat reductie als het oxidatiegetal afneemt.
Regels voor het toewijzen van oxidatiegetallen:
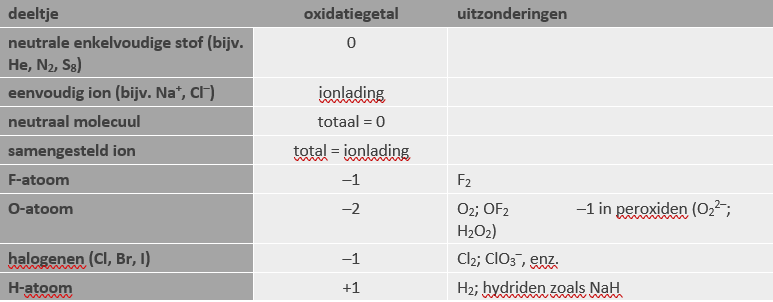
Wat is het oxidatiegetal van stikstof in NO2?
- De som van de oxidatiegetallen is 0. Elk zuurstofatoom heeft oxidatiegetal –2.
- Uit N + (–2) + (–2) = 0 volgt dat N = +4.
Wat is het oxidatiegetal van zwavel in CaSO4?
- Dit is een ionische verbinding van Ca2+ en SO42–. Dus heeft Ca oxidatiegetal +2, en de som van de oxidatiegetallen in SO42– is –2.
- Elk zuurstofatoom heeft oxidatiegetal –2.
- Uit S + 4x(-2) = -2 volgt dat S = +6.
Beschouw de reactie $\mathrm{2 PbS \; (s) + 3 O_2 \; (g) \rightarrow 2 PbO\; (s) + 2 SO_2 \; (g)}$. Welk element wordt geoxideerd? Welk element wordt gereduceerd?
- Het lood komt voor als Pb2+-atomen aan beide zijden. Zijn oxidatiegetal verandert niet.
- Zuurstof heeft oxidatiegetal 0 in O2, maar –2 in zowel PbO als SO2. Het zuurstof ondergaat dus reductie.
- Zwavel heeft oxidatiegetal –2 in PbS (het is een S2–-ion), maar +4 in SO2. Het zwavelatoom ondergaat dus oxidatie.
